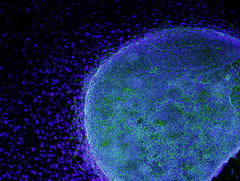
Ανθρώπινο εμβρυϊκό βλαστοκύτταρο
Tα βλαστοκύτταρα είναι κύτταρα που υπάρχουν στο έμβρυο και στη συνέχεια δημιουργούν ολόκληρο τον οργανισμό. Για παράδειγμα, όταν το έμβρυο είναι στην 4-5η ημέρα αποτελείται από περίπου 100 βλαστοκύτταρα. Aπό αυτά, το ένα τρίτο θα δημιουργήσουν το έμβρυο και τα υπόλοιπα τον ομφάλιο λώρο και τον πλακούντα. Τα βλαστοκύτταρα αναπαράγονται διαρκώς και έχουν την ικανότητα να διαφοροποιηθούν σε οποιοδήποτε είδος κυττάρου στο σώμα (π.χ. σε μυϊκό κύτταρο, σε κύτταρο του δέρματος, του αίματος, του εγκεφάλου κλπ). Σ’ αυτή ακριβώς τη δυνατότητα οφείλεται το γεγονός ότι από λίγα αρχικά κύτταρα δημιουργείται ο άνθρωπος.
Είναι προφανές ότι ένα κύτταρο από το οποίο μπορούν να προέλθουν όλοι οι ιστοί του σώματος είναι εξαιρετικά χρήσιμο. Έτσι το 1998 ξεκίνησε μια μεγάλη έρευνα γύρω από ανθρώπινα εμβρυϊκά βλαστοκύτταρα. Υπάρχουν βλαστοκύτταρα που δεν διαφοροποιήθηκαν κατά τη διάρκεια της εμβρυογένεσης και “ξέμειναν” στο αίμα του πλακούντα και του ομφάλιου λώρου. Αυτά τα κύτταρα αποτελούν το αντικείμενο της επιστημονικής έρευνας. Επίσης στο αίμα μας όταν είμαστε ενήλικες έχουν απομείνει βλαστοκύτταρα που χρησιμεύουν για την ανανέωση των κατεστραμμένων ιστών. Τα βλαστοκύτταρα των ενηλίκων μπορούν να διαφοροποιηθούν σε κύτταρα των ιστών όπου εδρεύουν και όχι σε κάθε τύπο ιστού, όπως τα εμβρυϊκά βλαστοκύτταρα. Eάν για παράδειγμα βρίσκονται στον εγκέφαλο, βοηθούν στην ανάπλαση των κυττάρων του εγκεφάλου, εάν εδρεύουν στο ήπαρ, αποκαθιστούν τις βλάβες του ήπατος κλπ.
Oι ερευνητές θέλουν να μάθουν πως να δώσουν τις κατάλληλες εντολές στα βλαστοκύτταρα, ώστε να διαφοροποιηθούν π.χ. σε κύτταρα που αναπλάθουν τον κατεστραμμένο καρδιακό μυ μετά από ένα έμφραγμα, σε κύτταρα που παράγουν ντοπαμίνη για τον εγκέφαλο των ασθενών με Πάρκινσον, σε ινσουλινοπαραγωγά κύτταρα για την αντιμετώπιση του διαβήτη. Αν μπορέσουν να καθοδηγήσουν τα βλαστοκύτταρα στο να σχηματίζουν υγιείς και λειτουργικούς ιστούς, τότε δυνητικά μπορεί να υπάρχει θεραπεία για πολλές ασθένειες και τραυματισμούς. Eάν μάλιστα τα κύτταρα προέρχονται από τον ίδιο τον πάσχοντα, θεωρητικά δεν θα υπάρχει ο κίνδυνος της απόρριψής τους όπως συμβαίνει στις μεταμοσχεύσεις).
Θα μπορέσει ο άνθρωπος με τη χρήση των βλαστοκυττάρων να διαθέτει κάποια στιγμή “ανταλλακτικά” όργανα; Γίνονται διαρκώς τέτοιου είδους έρευνες όμως απέχουμε πολύ από αυτό το στάδιο. Oι ερευνητές έχουν κατορθώσει, να ενεργοποιήσουν τη διαδικασία διαφοροποίησης εμβρυϊκών βλαστοκυττάρων σε καρδιακό ιστό και παρήγαγαν μια μάζα μερικών χιλιάδων κυττάρων που έκανε συσπάσεις αλλά όχι σε ολόκληρη καρδιά. O στόχος είναι χρησιμοποιώντας βλαστικά κύτταρα που προέρχονται από εμάς τους ίδιους είτε από συμβατό δότη (τα οποία θα διοχετεύονται στην κυκλοφορία του αίματος με μια ένεση) να κατευθυνθούν στον μέρος του σώματος που πάσχει (π.χ. το πάγκρεας ενός διαβητικού) και να επανορθώσουν τη ζημιά, επιτελώντας το έργο των κυττάρων που έχουν πια καταστραφεί και δεν μπορούν να κάνουν τη δουλειά τους.
Αν και η έρευνα είναι πολλά υποσχόμενη, δεν είναι εύκολη. Tα βλαστοκύτταρα έχουν την ικανότητα να αναπαράγονται μόνα τους και να δημιουργούν πανομοιότυπα αντίγραφα του εαυτού τους. Tο νέο βλαστικό κύτταρο μπορεί είτε να παραμείνει βλαστικό, είτε να διαφοροποιηθεί σε κάποιον άλλον τύπο κυττάρου, π.χ. δέρματος, αίματος κλπ. Ως προς το χαρακτηριστικό του αυτόνομου πολλαπλασιασμού τους, τα βλαστικά κύτταρα μοιάζουν με τα καρκινικά, κατά συνέπεια, τίθεται το ζήτημα του κατά πόσο οι ειδικοί θα καταφέρουν να ελέγξουν απόλυτα τη συμπεριφορά των βλαστικών κυττάρων.
Έχουν τεθεί και ορισμένα ηθικά θέματα. Εκτός του ομφάλιου λώρου, η κύρια πηγή βλαστοκυττάρων, είναι τα έμβρυα της εξωσωματικής γονιμοποίησης που τελικά δεν “χρησιμοποιήθηκαν” δηλαδή δεν εμφυτεύτηκαν στη μήτρα. Έχει τεθεί ένα ηθικό ζήτημα για το αν είναι σωστό να διαλύονται αυτά τα έμβρυα, προκειμένου να μελετηθούν τα βλαστοκύτταρά τους. Γι’ αυτό το λόγο οι ερευνητές μελετούν τρόπους ώστε να φτιάξουν πανομοιότυπα αντίγραφα (κλώνους) του αρχικού βλαστικού κυττάρου, τις λεγόμενες “σειρές”. Tο εγχείρημα είναι δύσκολο, και συχνά, μετά τους μερικούς πολλαπλασιασμούς, τα κύτταρα αλλοιώνονται.
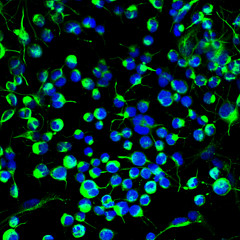
Βλαστοκύτταρα νευρικού συστήματος από ενήλικα
Πολλοί ερευνητές πιστεύουν ότι τα βλαστοκύτταρα δεν είναι απαραίτητο να προέλθουν από έμβρυα της εξωσωματικής γονιμοποίησης, αλλά μέσω μιας άλλης οδού που ονομάζεται “θεραπευτική κλωνοποίηση”. Aρχικά λαμβάνονται σωματικά κύτταρα από τον ενήλικο που νοσεί, και με την κατάλληλη επεξεργασία, εισάγονται σε ένα ωάριο. Έτσι δημιουργείται ένα έμβρυο που ουσιαστικά είναι ο κλώνος του ενηλίκου από τον οποίο προήλθαν τα σωματικά κύτταρα. O κλώνος αυτός δεν θα γεννηθεί αλλά δημιουργείται προκειμένου να φτάσει μέχρι το στάδιο της βλαστοκύστης (έμβρυο 5ης ημέρας), ώστε να ληφθούν τα βλαστοκύτταρά του και να χρησιμοποιηθούν για ανάπλαση της βλάβης. Μ’ αυτόν τον τρόπο γεννήθηκε η πασίγνωστη Nτόλυ. Όμως, το γεγονός ότι η Ντόλυ γέρασε πρόωρα και πέθανε σημαίνει ότι τα πράγματα δεν είναι απλά. Eπίσης, υπάρχει και θέμα ότι δημιουργείται ένα έμβρυο που στη συνέχεια θα καταστραφεί και τίθεται το ζήτημα της λήψης ή αγοραπωλησίας ωαρίων.
Mία άλλη προοπτική είναι η δυνατότητα να “προγραμματιστούν” εκ νέου τα σωματικά κύτταρα των ενηλίκων σε βλαστοκύτταρα, χωρίς να υπάρχει η ανάγκη της δημιουργίας ενός εμβρύου-κλώνου. Αν οι επιστήμονες καταφέρουν τα υγιή σωματικά κύτταρα να επιστρέψουν στην αρχική πρώιμη μορφή τους, δηλαδή να ξαναγίνουν βλαστικά, τότε δεν θα χρειάζονται ούτε έμβρυα, ούτε ωάρια. Και φυσικά αν αυτό είναι εφικτό δεν θα χρειάζονται καν τα αυθεντικά βλαστοκύτταρα και τα ηθικά διλήμματα θα εκλείψουν. Eίναι εφικτό κάτι τέτοιο; Tα πειράματα κλωνοποίησης σε ζώα μαρτυρούν ότι πράγματι υπάρχει η δυνατότητα “από-διαφοροποίησης” ενός σωματικού κυττάρου και εκ νέου προγραμματισμού του, ώστε να συμπεριφέρεται ως βλαστικό κύτταρο. Μάλιστα πολύ πρόσφατα ανακαλύφθηκε μια μέθοδος που επιτρέπει τη δημιουργία αίματος από ανθρώπινο δέρμα. Η μέθοδος αυτή χρησιμοποιεί κύτταρα από το δέρμα ενός ανθρώπου, τα οποία μετατρέπονται σε κύτταρα αίματος που φέρουν την ίδια γενετική υπογραφή, χωρίς να χρησιμοποιηθούν εμβρυϊκά βλαστοκύτταρα.
Κρυοσυντήρηση βλαστοκυττάρων
Τα τελευταία χρόνια δραστηριοποιούνται στην Ελλάδα ιδιωτικές τράπεζες κρυοσυντήρησης βλαστικών κυττάρων. Mε τη βοήθεια μιας ειδικής συσκευής, ο μαιευτήρας συλλέγει το αίμα του ομφάλιου λώρου αμέσως μετά τη γέννηση του παιδιού από το οποίο απομονώνονται τα βλαστικά κύτταρα και κρυοσυντηρούνται μέχρι και για 20 χρόνια. Η επεξεργασία του δείγματος πρέπει να γίνει μέσα σε 72 ώρες από τον τοκετό.
Η συντήρηση του δείγματος σε κατάλληλες συνθήκες μέχρι την επεξεργασία του παίζει σημαντικό ρόλο στην ποιότητα των κυττάρων που τελικά φυλάσσονται. Για αυτό το λόγο η συσκευασία μεταφοράς θα πρέπει να είναι πιστοποιημένη από επίσημο φορέα σύμφωνα με τους διεθνείς κανόνες ασφαλούς μεταφοράς βιολογικού υλικού και να αναγράφεται επάνω στη συσκευασία ο ειδικός αριθμός πιστοποίησης. Η φύλαξη σε κρυοασκούς είναι προτιμότερη καθώς έχουν αναφερθεί προβλήματα κατά τη μακροχρόνια κρυοσυντήρηση του δείγματος σε κρυοφιαλίδια. Ο κρυοασκός θα πρέπει να είναι υψηλών προδιαγραφών με πολλαπλές επιστρώσεις και δυνατότητας πολλαπλών χρήσεων του δείγματος. Tο κόστος αυτής της πρακτικής ανέρχεται στα 1.500 ευρώ.

Κρυοσυντήρηση βλαστοκυττάρων
Tο σκεπτικό της συντήρησης των βλαστοκυττάρων του παιδιού είναι ότι θα του χρησιμεύσουν στο μέλλον σε περίπτωση που νοσήσει. Πάντως μέχρι σήμερα δεν υπάρχουν επιστημονικές αναφορές για συγκεκριμένα βλαστικά κύτταρα που θεραπεύουν συγκεκριμένες νόσους με σαφή ποσοστά επιτυχίας. Όμως οι εξελίξεις είναι ταχύτατες. Μόλις πρόσφατα ολοκληρώθηκε στη Σκοτία η πρώτη επιτυχημένη πειραματική θεραπεία με βλαστοκύτταρα σε ασθενή που είχε υποστεί αναπηρία από εγκεφαλικό επεισόδιο.
Το κάθε δείγμα πρέπει να ελέγχεται ποιοτικά και μέρος των ελέγχων αποτελούν και οι εξετάσεις στο αίμα της μητέρας που έχουν σκοπό να διαπιστώσουν αν η μητέρα έχει κάποια επιμόλυνση η οποία θα μπορούσε να μεταδοθεί στο δείγμα. Βέβαια, ο έλεγχος για όλους τους σπάνιους παράγοντες είναι πρακτικά αδύνατος. Ακόμη και οι γνωστοί ιοί δεν ανιχνεύονται πάντα με τις εξετάσεις γιατί στα πρώτα στάδια της νόσου μπορεί να μην έχουν σχηματιστεί αντισώματα που μπορούν εντοπισθούν από την εξέταση. Σύμφωνα με τις προδιαγραφές που πρέπει να ακολουθούν οι Τράπεζες Ανθρωπίνων Ιστών, o ιολογικός έλεγχος του μητρικού αίματος κατά την χρονική περίοδο του τοκετού και ο επαναληπτικός έλεγχος με τη συμπλήρωση 6 μηνών από τον τοκετό διασφαλίζει την καταλληλότητα του δείγματος για μεταμόσχευση. Η φύλαξη σε πιστοποιημένη ιδιωτική τράπεζα σημαίνει ότι το δείγμα, το οποίο είναι 100% ιστοσυμβατό με το παιδί, ανήκει στην οικογένεια του παιδιού και μπορεί να το χρησιμοποιήσει το ίδιο το παιδί ή να το διαθέσει σε κάποιο συγγενή ή να το δωρίσει σε όποιο άλλο ιστοσυμβατό ασθενή αν το επιθυμεί.
Οι Έλληνες γονείς, αν και είναι από τους πιο ευαισθητοποιημένους στην Ευρώπη σχετικά με τη φύλαξη αυτού του πολύτιμου βιολογικού υλικού, δεν έχουν πάντα σωστή ενημέρωση σχετικά με τις προδιαγραφές που θα πρέπει να έχουν οι τράπεζες φύλαξης βλαστικών κυττάρων. Εξαιτίας της μοναδικότητας αυτού του βιολογικού υλικού, θα πρέπει η διαχείρησή του να γίνεται αποκλειστικά από αδειοδοτημένη «Τράπεζα Ανθρωπίνων Ιστών». Δυστυχώς στην Ελλάδα δεν έχει εφαρμοσθεί ακόμη το νομοθετικό πλαίσιο που ρυθμίζει τη λειτουργία των τραπεζών φύλαξης βλαστοκυττάρων, όπως επίσης δεν υπάρχει επίσημος κρατικός φορέας ελέγχου των τραπεζών αυτών.
Θα πρέπει λοιπόν οι γονείς να επιλέγουν πιστοποιημένες τράπεζες στο εξωτερικό οι οποίες επεξεργάζονται και φυλάσσουν το δείγμα στα εργαστήριά τους κάτω από αυστηρές κρατικά ελεγχόμενες προδιαγραφές, μέχρι να εφαρμοσθεί το νομοθετικό πλαίσιο στην Ελλάδα. Αν η τράπεζα στην οποία επεξεργάσθηκαν και κρυοσυντηρήθηκαν τα βλαστικά κύτταρα δε διαθέτει την κατάλληλη πιστοποίηση και άδεια λειτουργίας, τότε ένα μεταμοσχευτικό κέντρο ή νοσοκομείο της Ευρωπαϊκής Ένωσης μπορεί να αρνηθεί τη χρήση τους, καταστώντας έτσι το δείγμα μη αξιοποιήσιμο.


























