Ο όρος «Myasthenia gravis» (βαριά μυασθένεια) προέρχεται απ’ την ελληνική λέξη «μυασθένεια» (ασθένεια των μυών) και το λατινικό «gravis» που σημαίνει βαρύ, σοβαρός.
Οι πρώτες αναφορές στη μυασθένεια εντοπίζονται τον 17ο αιώνα, όταν ο Δρ. Thomas Willis ανέφερε «μια γυναίκα που μιλούσε εύκολα και αβίαστα για λίγο, αλλά μετά από μεγάλο διάστημα ομιλίας, δε μπορούσε να αρθρώσει λέξη για μία ή δυο ώρες».
Στη δεκαετία του 1930, αποδείχθηκε ότι η μυασθένεια οφείλεται σε μια ατέλεια της νευρομυϊκής σύναψης και 30 χρόνια αργότερα υποστηρίχθηκε ότι ήταν ένα αυτοάνοσο νόσημα, δηλαδή επίθεση αντισωμάτων στους μυς του ίδιου του ατόμου. Η υπόθεση αυτή επιβεβαιώθηκε στα μέσα της δεκαετίας του 1970 από τους δρες J. Patrick και J. Lindstrom, και την ανακάλυψη συγκεκριμένων αυτοαντισωμάτων στους περισσότερους ασθενείς, που κατέστρεφαν στόχους – πρωτεΐνες στις νευρομυϊκές συνδέσεις. Ο κανονικός ρόλος των αντισωμάτων είναι να καταστρέφουν μολυσματικά βακτήρια ή ιούς. Γι’ αυτό η μυασθένεια περιλαμβάνεται στα αυτοάνοσα νοσήματα, μεταξύ των οποίων είναι η θυρεοειδίτιδα Hashimoto, ο διαβήτης τύπου 1, η πολλαπλή σκλήρυνση, η ρευματοειδής αρθρίτιδα και ο ερυθηματώδης λύκος.
Τα συμπτώματα
Η μυασθένεια μπορεί να προσβάλει τον καθένα, από έμβρυα μέχρι ηλικιωμένους, άνδρες και γυναίκες. Όσον αφορά την ηλικία πιθανής εμφάνισης, φαίνεται ότι υπάρχουν δυο ομάδες υψηλού κίνδυνου: πρώιμη μυασθένεια σε γυναίκες μεταξύ 20 και 40 ετών (early onset MG), και μυασθένεια που εμφανίζεται σε μεγαλύτερες ηλικίες κυρίως σε άνδρες πάνω από 40 ετών (late onset MG). Δεν είναι κληρονομική και πλήττει 1 στους 10.000 ανθρώπους.
Περίπου το 2% των μυασθενικών έχουν κληρονομήσει κάποιο ελάττωμα στη νευρομυϊκή σύναψη. Σ’ αυτή την περίπτωση, η ασθένεια ονομάζεται «συγγενής μυασθένεια» και δεν έχει σχέση με το ανοσοποιητικό σύστημα οπότε οι θεραπείες που επιτίθενται στα αντισώματα (όπως τα στεροειδή) είναι τελείως ακατάλληλες – αντίθετα απ’ την αυτοάνοση μυασθένεια.
Τα νεογέννητα, των οποίων η μητέρα πάσχει από μυασθένεια, μπορεί επίσης να εμφανίσουν παροδική αδυναμία που οφείλεται στη μεταφορά αυτοαντισωμάτων από τη μητέρα στο μωρό μέσω του πλακούντα ή/και του γάλακτος. Αυτό δεν είναι όμως συχνό: μόνο το 10-15% των νεογέννητων παρουσιάζουν συμπτώματα, τα οποία συνήθως υποχωρούν μετά από 1-3 εβδομάδες και εξαφανίζονται τελείως μετά από λίγο. Η παρουσία μυασθένειας στη μητέρα, βοηθάει συνήθως να αποκλεισθεί η κληρονομική μυασθένεια.
Το κυριότερο σύμπτωμα της νόσου είναι η αδυναμία των εκουσίων μυών χωρίς αισθητηριακά συμπτώματα ή πόνο. Η αδυναμία αυξάνεται όσο περισσότερο χρησιμοποιούνται οι μύες κατά τη διάρκεια της ημέρας, επέρχεται δηλαδή κούραση, αλλά βελτιώνεται με την ανάπαυση. Συχνά η αδυναμία διαφέρει από μέρα σε μέρα ή από μήνα σε μήνα. Μπορεί επίσης να επιδεινωθεί γρήγορα, για παράδειγμα μετά από μολύνσεις.
Πώς εξελίσσεται η ασθένεια
Οι πρώτοι μύες που προσβάλλονται σε πολλούς ασθενείς είναι οι μύες του ματιού, οπότε έχουμε πτώση βλεφάρων ή διπλωπία. Άλλοι ασθενείς υποφέρουν στο πρόσωπο, κατά την κατάποση ή την ομιλία ή/και στους μυς του λαιμού, του κορμού ή των άκρων. Στις πολύ βαριές περιπτώσεις, η αναπνοή μπορεί να είναι τόσο επώδυνη ώστε ο ασθενής να χρειάζεται μηχανική υποστήριξη.
Στο 10-20% των ασθενών η αδυναμία περιορίζεται στα μάτια για πολλά χρόνια (οφθαλμική μυασθένεια). Στο υπόλοιπο ποσοστό, αρχίζει να επηρεάζει άλλες μυϊκές ομάδες συνήθως μέσα στα τρία πρώτα χρόνια (γενικευμένη μυασθένεια). Όπως και σε άλλα αυτοάνοσα νοσήματα, τα συμπτώματα μπορεί να ποικίλουν από καιρό σε καιρό ή να μετριάζονται περίπου στο 5% των ασθενών κάθε χρόνο. Η νόσος χαρακτηρίστηκε gravis (βαριά) γιατί πριν βρεθεί θεραπεία, γύρω στα 1930 με 1950, οι περισσότεροι ασθενείς πέθαιναν από αυτήν.
Αιτία: Τι δε λειτουργεί σωστά
Όταν ο εγκέφαλος στέλνει ένα ηλεκτρικό ερέθισμα μέσω των νεύρων στο μυ για να κινηθεί, από τις νευρικές απολήξεις απελευθερώνεται ένας χημικός διαβιβαστής: η ακετυλοχολίνη (ACh) η οποία φτάνει αμέσως στο μυ και «κλειδώνει» πάνω στους υποδοχείς ακετυλοχολίνης (AChR), προκαλώντας την αντίδραση του μυός. Στη συνέχεια, η διαθέσιμη ακετυλοχολίνη διασπάται από ένα ένζυμο που λέγεται ακετυλοχολινεστεράση, κάτι που επιτρέπει στο μυ να χαλαρώσει.
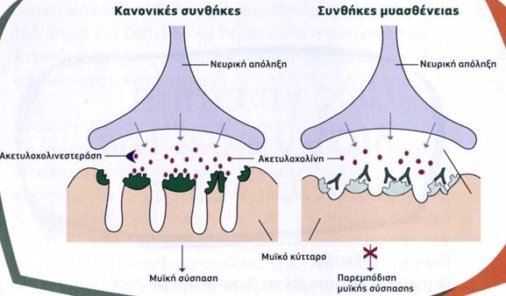
Στην περίπτωση της ασθένειας, η υποδοχείς της ακετυλοχολίνης δεν λειτουργούν καλά. Η παρουσία αυτοαντισωμάτων που προσδένονται στους υποδοχείς της ακετυλοχολίνης προκαλεί ελάττωση της λειτουργίας των υποδοχέων ακετυλοχολίνης. Επειδή υπάρχουν λίγοι υποδοχείς διαθέσιμοι και δεν επαρκούν για τη νευρομυϊκή σύναψη. Να σημειωθεί ότι κάποιοι ασθενείς μπορεί να έχουν αυτοαντισώματα σε άλλα μόρια, κοντά στους υποδοχείς ακετυλοχολίνης στην περιοχή της νευρομυϊκής σύναψης που μπορεί να δράσουν έμμεσα στους υποδοχείς ακετυλοχολίνης.
Δεν είναι ακόμα γνωστό για ποιο λόγο το σώμα παράγει τα αυτοαντισώματα. Ίσως υπάρχουν εξωτερικοί γενεσιουργοί παράγοντες, όπως μολύνσεις ή φάρμακα. Δεν είναι γνωστό πως και γιατί ξεκινάει η ασθένεια.
Περίπου το 10% των ασθενών με βαριά μυασθένεια, συχνά μεταξύ 40-60 ετών, έχουν όγκο στο θύμο αδένα (θύμωμα). Τα θυμώματα περιορίζονται στο θύμο αδένα (μη-επιθετικά) και τείνουν να μεγαλώνουν πολύ αργά, αλλά μπορεί, αν και σπάνια, να γίνουν κακοήθη και να επανεμφανιστούν τοπικά πολλά χρόνια μετά την αφαίρεση. Γι’ αυτό είναι σημαντικό οι ασθενείς με θυμώματα να παρακολουθούνται τακτικά, αλλά και και η επιδείνωση των μυασθενικών συμπτωμάτων απαιτεί άμεση εξέταση.
Επιπλέον, τα 2/3 περίπου των ασθενών παρουσιάζουν ήπιες ανωμαλίες στο θύμο αδένα όπως θυμική υπερπλασία στην πρώιμη και θυμική ατροφία στη late onset μυασθένεια. Η σχέση μεταξύ των αλλαγών στο θύμο αδένα και τη μυασθένεια δεν είναι ακόμα εντελώς ξεκάθαρη. Πολλοί ερευνητές προσπαθούν να κατανοήσουν αυτές τις διαδικασίες ώστε να εφαρμόσουν καλύτερα στοχευμένες θεραπείες ή ακόμα και να προλάβουν την ασθένεια.
Πώς γίνεται η διάγνωση
Κλινική εξέταση. Η βαριά μυασθένεια μπορεί να διαγνωστεί με βάση το ιστορικό και τη μυϊκή αδυναμία του ασθενή, που συνήθως είναι εμφανής κατά την εξέταση. Παρόλα αυτά, σε ήπιες περιπτώσεις, μπορεί να γίνει αντιληπτή μόνο με τον έλεγχο των μυϊκών αντιδράσεων, π.χ. το σήκωμα των ώμων ή το κοίταγμα προς τα πάνω (για 1 λεπτό περίπου) που προκαλεί βλεφαρόπτωση. Επειδή η βαριά μυασθένεια είναι σπάνια με διακυμάνσεις, η διάγνωση δεν γίνεται εύκολα, ειδικά στους ηλικιωμένους.
Έλεγχος αυτοαντισωμάτων. Η διάγνωση επιβεβαιώνεται από μια εξέταση αίματος για αντισώματα έναντι των υποδοχέων ακετυλοχολίνης στους περισσότερους ασθενείς. Εντούτοις, αυτά τα αντισώματα, δεν εντοπίζονται στο 50% περίπου των ασθενών με αμιγώς οφθαλμική μυασθένεια και σε περίπου 15% όσων έχουν τυπική γενική αδυναμία. Η μυασθένεια σε αυτούς τους ασθενείς όμως βελτιώνεται με την ανταλλαγή πλάσματος, μέθοδος που χρησιμοποιείται για την απομάκρυνση αντισωμάτων που δεν εντοπίζονται με τις συνήθεις εξετάσεις.
Σήμερα γνωρίζουμε ότι περίπου στο 1/3 των ασθενών που δεν έχουν αντισώματα έναντι των υποδοχέων ακετυλοχολίνης, τα αντισώματα αναγνωρίζουν τον κοντινό στόχο που λέγεται muscle-specific kinase (MuSK) και συμμετέχει στη συγκέντρωση υποδοχέων ακετυλοχολίνης στις νευρομυϊκές συνάψεις. Η αδυναμία τους επηρεάζει το πρόσωπο και το λαιμό ακόμη περισσότερο απ’ ό,τι στην τυπική μυασθένεια. Η μυασθένεια μπορεί να είναι πιο βαριά και δύσκολο να θεραπευθεί στους ασθενείς με αντισώματα έναντι του MuSK, αλλά ο θύμος αδένας είναι σχεδόν πάντα κανονικός.
Ηλεκτρομυογράφημα και άλλες εξετάσεις. Το ηλεκτρομυογράφημα (ΗΜΓ) είναι μια χρήσιμη εξέταση για την αντίδραση του μυός σε ένα ηλεκτρικό ερέθισμα ανά διαστήματα. Συνήθως, στη μυασθένεια, η ηλεκτρική εκκένωση στο μυ μειώνεται σταδιακά (-10%).
Η αύξηση της μυϊκής δύναμης μετά την παροχή ακετυλοχολινεστεράσης μπορεί να μετρηθεί πριν και μετά το βραχείας δράσης φάρμακο εδροφώνιο (Tensilon® ή Camsilon®) ενδοφλεβίως ή τη πυριδοστιγμίνη (Mestinon®), μια παραλλαγή με πιο αργή δράση, από το στόμα. Όταν διαγνωστεί η μυασθένεια, πρέπει να αναζητηθεί συσχετιζόμενο θύμωμα. Επίσης, ο ειδικός έλεγχος του στήθους, που μετράει την αναπνευστική δύναμη μπορεί να βοηθήσει να προβλεφθεί κάποιο σφάλμα στην αναπνοή που μπορεί να οδηγήσει σε μυασθενική κρίση.
Θεραπεία
Η μυασθένεια μπορεί να τεθεί σχεδόν πάντα υπό πλήρη έλεγχο και οι περισσότεροι ασθενείς ζουν μια κανονική ζωή. Ελάχιστοι ασθενείς που πάσχουν από μυασθένεια πεθαίνουν. Η μυασθένεια μπορεί να θεραπευθεί, ακόμα και χωρίς θεραπεία, αλλά μόνο σε έναν στους 20 με 30 ασθενείς το χρόνο.
Θα χρειαστείτε σχεδόν σίγουρα φάρμακα θα υπάρχουν κάποιες παρενέργειες. Πάντως, οι θεραπείες για τη μυασθένεια είναι πιο αποτελεσματικές από ό,τι οι θεραπείες για πολλά άλλα αυτοάνοσα νοσήματα. Δεν είναι τόσο επώδυνες και υπάρχουν λιγότερες σοβαρές μακροπρόθεσμες επιπλοκές.
Η αντιμετώπισης της μυασθένειας περιλαμβάνει:
Τόνωση της νευρομυϊκής λειτουργίας. Γίνεται κυρίως με πυριδοστιγμίνη ή νεοστιγμίνη. Αυτά τα φάρμακα πρώτης γραμμής μπλοκάρουν την ακετυλοχολινεστεράση, έτσι ώστε η ακετυλοχολίνη να διατηρείται περισσότερο και να έχει περισσότερες πιθανότητες να ενεργοποιήσει το μυ. Τα φάρμακα αυτά ενισχύουν απλώς τη μυϊκή σύσπαση. Πολλοί ασθενείς μπορεί να χρειαστούν κάτι περισσότερο για την καταπολέμηση της υποκρυπτόμενης αντίδρασης των αντισωμάτων.
Αφαίρεση των βλαβερών αντισωμάτων με πλασμαφαίρεση. Η πλασμαφαίρεση χρησιμοποιείται για την απομάκρυνση των αντισωμάτων του ασθενή από το αίμα του, ενώ τα κύτταρα του αίματος μεταγγίζονται ξανά πίσω στον ασθενή. Αυτό σημαίνει ότι ο ασθενής παραμένει για περίπου 5 ημέρες στο νοσοκομείο και συνήθως η μυασθένεια αρχίζει να βελτιώνεται. Τα αποτελέσματα διαρκούν για περίπου 4-6 εβδομάδες, γιατί στο σώμα του ασθενή αρχίζουν να παράγονται καινούρια αντισώματα. Η πλασμαφαίρεση είναι ιδιαίτερα χρήσιμη όταν απαιτείται άμεση βελτίωση, για παράδειγμα πριν και μετά τη θυμεκτομή, και όταν αρχίζει θεραπεία με στεροειδή (ή κατά τη διάρκεια της θεραπείας, σε κάποιες δύσκολες περιπτώσεις). Η πλασμαφαίρεση σε συνδυασμό με στεροειδή ενδείκνυται για πολύ βαριές μορφές μυασθένειας.
Αφαίρεση των βλαβερών αντισωμάτων με ενδοφλέβιες ανοσοσφαιρίνες (IvIg): Τα τελευταία χρόνια, την πλασμαφαίρεση έχει αντικαταστήσει σε μεγάλο βαθμό η IvIg, που είναι η μετάγγιση ενός μέρους του αντισώματος που συγκεντρώνεται από υγιείς δότες. Αυτό φαίνεται να έχει αποτελέσματα στη μυασθένεια καθώς αραιώνει η μεταβάλλει τα βλαβερά αντισώματα. Μπορεί να χρησιμοποιηθεί σε συνδυασμό με ανοσοκατασταλτικά φάρμακα ή όταν η πρόσβαση στις φλέβες του ασθενή για τη μετάγγιση πλάσματος είναι για κάποιο λόγο δύσκολη. Αργεί περισσότερο να δράσει από ότι η πλασμαφαίρεση, αλλά τα αποτελέσματα μπορούν να διαρκέσουν πολλές εβδομάδες. Παρόλα αυτά, είναι ακριβή θεραπεία, ενώ έχουν αναφερθεί προβλήματα στην προμήθεια ανοσοσφαιρίνης.
Θυμεκτομή: Ο θύμος αδένας παίζει πολύ σημαντικό ρόλο στην ανάπτυξη του ανοσοποιητικού συστήματος. Η αφαίρεσή του (θυμεκτομή) χρησιμοποιείται από το 1940 ως μακροπρόθεσμη θεραπεία των μυασθενών που επαναφέρει την ισορροπία του ανοσοποιητικού συστήματος και μπορεί να χαμηλώσει, πολύ αργά, τα επίπεδα των αντισωμάτων. Κάποιοι νευρολόγοι θεωρούν ότι βοηθάει ασθενείς που έχουν εμφανίσει μυασθένεια πριν την ηλικία των 45, κυρίως αν εφαρμοστεί στην αρχή της νόσου, αν και αυτό δεν έχει αποδειχθεί ακόμη. Παρόλα αυτά, όταν υπάρχει κάποιο θύμωμα, οι γιατροί συμφωνούν ότι πρέπει να αφαιρείται ο θύμος αδένας για να αποφευχθεί η επέκταση, αν και η αφαίρεση του συνήθως δε βελτιώνει την κατάσταση της ασθένειας.
Ανοσοκατασταλτικά και αντιφλεγμονώδη φάρμακα: Τα φάρμακα αυτού του είδους αποτελούν τη σημερινή μέθοδο θεραπείας της μέτριας έως βαριάς μορφής μυασθένειας. Αυτό που χρησιμοποιείται πιο συχνά είναι η πρεδνιζολόνη, ιδίως στην οφθαλμική μυασθένεια.
Τα κορτικοστεροειδή μειώνουν αποτελεσματικά τα επίπεδα των αυτοαντισωμάτων του υποδοχέα αλλά μπορεί να προκαλέσουν και παρενέργειες, όπως αύξηση του βάρους, υψηλή πίεση, διαβήτη, άγχος, κατάθλιψη, αϋπνία, μείωση της οστικής μάζας, καταρράκτη και γαστρεντερικές διατρήσεις.
Μακροπρόθεσμα, οι ασθενείς μπορούν να δοκιμάσουν μικρότερες δόσεις, σε συνδυασμό με ανοσοκατασταλτικά φάρμακα όπως η αζαθειοπρίνη ή η κυκλοσπορίνη Α (για ασθενείς αλλεργικούς στην αζαθειοπρίνη).

























